Traitement par ilomédine
Indications habituelles
avec troubles trophiques en évolution
Chez les patients à risque d’amputation et chez lesquels la revascularisation par chirurgie ou angioplastie a échoué ou n’est pas indiquée après confrontation médico-radio-chirurgicale.
[Il est à noter que la HAS a rendu un avis défavorable concernant son remboursement dans cette indication le 24/12/2019]
Contre - indications
Ce médicament ne doit jamais être administré dans les situations suivantes :
- Grossesse, allaitement,
- Hypersensibilité à l’iloprost® ou à l’un des excipients,
- Affections où le risque hémorragique peut être accru à cause des effets de l’iloprost® sur les plaquettes (par exemple ulcère gastrique ou duodénal en évolution, traumatisme, hémorragie intracrânienne),
- Troubles coronariens sévères ou angor instable,
- Infarctus du myocarde dans les six mois précédents,
- Insuffisance cardiaque aiguë ou chronique (classification NYHA II à IV),
- Troubles du rythme sévères,
- Œdème pulmonaire.
En pharmacologie expérimentale l’iloprost augmente l’effet hypotenseur des bêtabloquants, des antagonistes calciques et des vasodilatateurs, et il potentialise celui des inhibiteurs de l’enzyme de conversion.
L’iloprost peut inhiber l’agrégation plaquettaire ; en conséquence, l’administration concomitante d’anticoagulants oraux et/ou d’héparine fractionnée ou non fractionnée et molécules apparentées et/ou de thrombolytiques et/ou d’autres antiagrégants plaquettaires peut augmenter le risque hémorragique. La majoration possible du risque hémorragique doit être prise en compte en maintenant une surveillance clinique étroite.
En cas d’hémorragie, il est souhaitable d’envisager un arrêt de la perfusion d’Ilomédine.
Posologie et mode d'administration
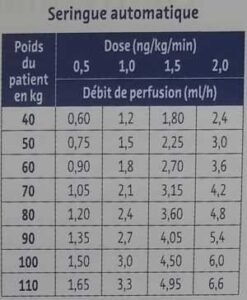
Le débit de perfusion doit être calculé en fonction du poids du patient de façon à obtenir une posologie comprise entre 0,5 et 2 ng/kg/min (en utilisant un pousse seringue électrique)
Pour le PSE on prend une ampoule de 0,5 ml (contenant 50 µg d’ilomédine) qu’on ramène à 25 ml (avec du SSI 0.9% ou du SGI 5%) dans une seringue de 50 ml. Ce qui correspond à une concentration de 2 µg/ml.
Dans le cas suivant, on débute le traitement chez un patient de 60 kg.
Le palier de départ est de 0,5 ng/kg/min, la vitesse de départ est de 0,9 ml/h qui va passer à 1,8 ml/h après 30 minutes (si pas d’effets secondaires) puis 2,7 ml/h pour finir au maximum à 3,6 ml/h.
Cette progression peut se faire sur 3 jours
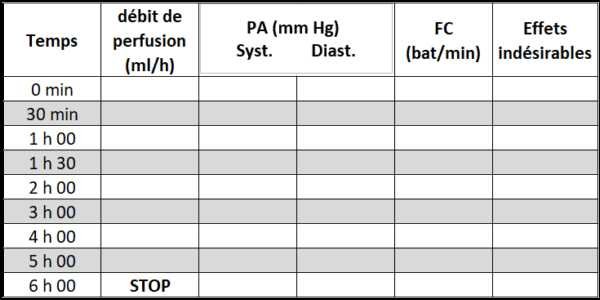
Surveillance
Avant la mise en route de la perfusion et à chaque palier d’augmentation de dose, contrôler :
– Pression artérielle,
– Fréquence cardiaque,
– Effets indésirables
Si effets indésirables (céphalées, nausées, baisse de pression artérielle), réduire le débit de perfusion jusqu’à trouver la dose maximale bien tolérée.
Les 3 premiers jours
Les 3 premiers jours sont utilisés pour déterminer la dose maximale bien tolérée par le patient.
Au jour 2 on démarre à la dose finale bien tolérée du jour 1 pour essayer d’augmenter jusqu’au maximum autorisé.
On procède de même à J3 (on démarre à la dose max de J2)
A partir du jour 4 (si le traitement se poursuit) continuer à la vitesse du jour 3.
Pour la sclérodermie, le Pr B. GRANEL (PU-PH de médecine interne Aix Marseille Université (AMU) – Hôpital Nord (AP-HM)) recommande de démarrer le traitement les 3 premiers jours à la posologie initiale de 0,5 ng/kg/min et poursuivre à la dose maximale tolérée à partir de J4 si le traitement se prolonge au delà.
de J4 à J28
Important
A la fin de la perfusion (à la 6e heure) on obture le kt.
On ne rince pas la tubulure en fin de perfusion !
De nombreux effets secondaires surviennent en fin de traitement suite à un rinçage de la tubulure.
Si on doit utiliser le kt il faudra remplacer en fin de traitement la seringue d’ilomédine ainsi que son prolongateur par une seringue de SSI 0.9% (ou de SGI 5%) et la lancer à la dernière vitesse utilisée (pour que la tubulure qui contient environs 1 ml soit vidée du produit).
Mise à jour de juin 2022







Vous devez être connecté pour poster un commentaire.