Le choc hémorragique est un type de choc hypovolémique causé par une perte de sang extravasculaire.
Cette perte de sang diminue le volume circulant, ce qui entraîne une insuffisance circulatoire aiguë.
Le choc hémorragique est caractérisé par une chute brutale et durable de la pression artérielle (PAS < 90 mmHg ou baisse de 30% par rapport aux chiffres habituels) associée à une réduction aiguë de la masse sanguine (anémie aiguë).
Les causes les plus fréquentes sont :
- les hémorragies digestives,
- les hémorragies d’origine traumatique,
- les hémorragies en contexte chirurgical et
- les hémorragies du post-partum.
Diagnostic
Diminution du débit cardiaque
Tachycardie (FC > 100 bpm) et l’hypotension artérielle (PAS < 90 mmHg ou PAM < 65 mmHg ou diminution de 30 % chez un hypertendu connu) sont des signes d’un choc hémorragique.
La SpO2 est généralement conservée, sauf en cas d’atteinte pulmonaire associée.
Réduction aiguë de la masse sanguine
Pour faire le diagnostic d’anémie on peut avoir recours à l’HemoCue® généralement disponibles dans les services d’urgences ou aux gaz du sang disponibles dans les réanimations (résultats sur place en quelques minutes) ou à une NFS (prendre en compte le temps de transport du tube vers le laboratoire).
Ces examens réalisés au tout début peuvent sous-estimer la perte sanguine, car l’anémie ne commence à apparaitre que quelques heures après le début du saignement suite aux transferts liquidiens vers le secteur vasculaire pour compenser la perte volémique et se poursuivent 12 à 24 h après l’arrêt du saignement (la phase de régénération des globules rouge ne débute qu’après 2 à 3 jours). C’est la perfusion de solutés cristalloïdes dès le début pour maintenir la pression artérielle qui démasque rapidement l’anémie à la NFS.
Appréciation de la gravité du choc
En fonction des signes d’hypoperfusion tissulaire (marbrures cutanées, allongement du temps de recoloration capillaire, extrémités froides), des signes de souffrance d’organes (neurologique, rénal, cardiaque) et de l’estimation des pertes sanguines (quantification des pertes à l’interrogatoire, variations de l’hémoglobine du patient ou à défaut la profondeur de l’anémie).
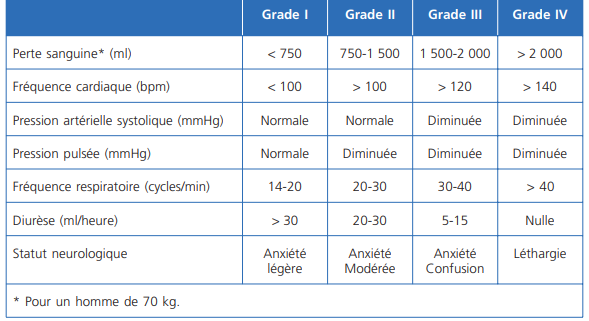 (d’après l’American College of Surgeons Committee on Trauma)
(d’après l’American College of Surgeons Committee on Trauma)
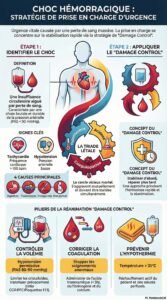
Conduite à tenir
Déchocage
Monitorage des paramètres vitaux, deux voies veineuses périphériques, et admettre le patient en salle de déchoquage et/ou secteur de réanimation.
Identifier la cause de l’hémorragie et contrôler le saignement
- Contrôler le saignement extériorisé par la pression directe ou le garrot
- Clamp pelvien / ceinture pelvienne en cas de de fracture du bassin,
- et l’appel des spécialistes en cas de :
- plaie vasculaire,
- d’hémorragie obstétricale,
- d’hémorragie intra-abdominale ou d’hémorragie digestive.
Premiers traitements symptomatiques :
Bloquer la triade létale (de Moore):
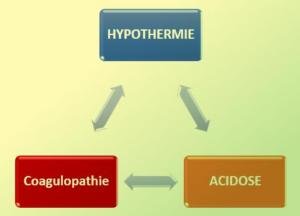
De nombreuses études montrent que les réactions enzymatiques de la cascade de coagulation est fortement inhibée par l’hypothermie, d’où l’intérêt de prévenir, rechercher et corriger toute hypothermie (t° < 35°C). Les moyens possibles sont :
- Couverture de survie, retrait des vêtements mouillés.
- Mettre le patient dans un environnement chauffé.
- Réchauffement des solutés de perfusions (réchauffeurs de sang +++)
- Couverture chauffante.
→ Effet de l’hypothermie sur la cascade de coagulation (+ articles similaires sur la page de l’étude).
L’acidose chez le traumatisé est due à l’hypoperfusion tissulaire, qui diminue l’élimination urinaire des métabolites acides et leur accumulation.
L’acidose est définie par un (pH) < 7,35 dans le sang.
La baisse du pH est un facteur de risque de survenue d’une coagulopathie.
Une baisse du pH de 7,4 à 7,0 a réduit l’activité du Facteur VIIa de plus de 90 % et celle du complexe Facteur VIIa et TF (FT = facteur tissulaire) de plus de 60 %.
Selon Meng ZH et al. The effect of temperature and pH on the activity of factor VIIa: implications for the efficacy of high-dose factor VIIa in hypothermic and acidotic patients. J Trauma 2003 ; 55(5) : 886-91n
- TP < 50% ou INR > 1,5
- Fibrinogène < 1,5 g/L
- Thrombopénie < 50 000 /ml (ou < 50 G/L)
Prévention des anomalies de l’hémostase :
- Limitation de la perfusion des cristalloïdes (1 – 1,5 L de NaCl isotonique) car risque de dilution des facteurs de la coagulation et recours précoce aux amines (noradrénaline) objectifs tensionnels modestes (hypotension permissive : PAS > 80 mmHg ou > 100 mmHg si Trauma Crânien Grave) tant que le saignement est actif.
- Recours précoce aux produits sanguins labiles (Sang, PFC et plaquettes).
- O+ en cas d’extrême urgence (le O négatif est réservé à la femme en âge de procréer).
- CGR pour une hémoglobine entre 7 et 9 g/dL et 1 PFC pour 1 CGR
- Plaquettes > 50 000 (100 000 si TCG )
- Fibrinogène > 1,5 g / L (on charge avec 3 à 4 g de fibrinogène puis on adapte aux dosages biologiques).
Correction des anomalies de l’hémostase :
- Injection de Concentré de Complexe Prothrombinique (CCP) = efficace en quelques minutes + 10 mg Vit. K pour les patients sous AVK (pour prendre le relais et permettre la production des facteurs K dépendants)
(dose habituelle = 25 UI/kg équivalent facteur IX et peut aller jusqu’à 50 UI/kg) - Administration d’acide tranexamique (= anti fibrinolytique) avant la 3e heure : 1 g sur 10 minutes, puis 1 g sur 8 heures.
(Recommandations européennes = 10 à 15 mg/kg d’acide tranexamique, puis 1 – 5 mg/kg/h ou de 100 à 150 mg/kg d’acide ε-aminocaproïque). - Calcium ionisé > 1 mmol/L
Remarque : il faut 3 ml/kg de CGR pour augmenter de 1 g/dL l’hémoglobine (et 6 ml / kg pour le sang total).
Pour plus d’infos …
→ Gestion des accidents d’anticoagulation aux urgences
→ Antagonisation des anticoagulants
Traitement étiologique
- En cas d’hémorragie digestive :
- Endoscopie digestive haute en cas d’hématémèse et/ou méléna, éventuellement complétée par une endoscopie basse si négative ou si rectorragies.
- Si contexte traumatique :
- scanner injecté « corps entier » si le patient est stable sur le plan hémodynamique.
- Si patient très instable et intransportable = Radio thorax + bassin et FAST-écho, puis chirurgie courte dite de « damage control » si hémopéritoine. Une reprise chirurgicale peut être envisagée 48 à 72 h après stabilisation (= chirurgie de « second look »).
Concept de "Damage control"
Issu de la marine militaire, ce concept désigne les mesures pour maintenir à flot un navire pour lui permettre de continuer sa mission malgré les dommages.
En médecine, il s’applique à la gestion des urgences traumatiques avec plusieurs principes clés :
Arrêter les saignements rapidement (chirurgie limitée et hémostase rapide) et prévenir la contamination
Stabiliser les fonctions vitales (par réanimation et correction des déséquilibres physiologiques).
Reprise chirurgicale différée pour finaliser les réparations une fois l’état du patient optimisé.
- Doit impliquer collectivement tous les acteurs, principe de chaine de survie qui commence dès le préhospitalier : le meilleur chirurgien ou coronarographiste ne peut rien faire si le patient n’arrive pas vivant sur table et inversement à quoi pourrait servir une réanimation optimale si le patient arrive entre les mains d’un chirurgien inexpérimenté.
- S’appuyer sur des procédures précises et documentées
Damage Control Chirurgical
Comment ?
Hémostase rapide : Ligature ou contrôle des vaisseaux saignants (parfois par tamponnement temporaire).
Contrôle des fuites digestives : Sutures ou fermeture temporaire des perforations intestinales (ou abouchement temporaire à la peau) pour éviter une péritonite.
Tamponnement abdominal : Utilisation de compresses (packing) pour contrôler les saignements intra-abdominaux diffus.
Fermeture temporaire : En cas de laparotomie, fermeture temporaire de l’abdomen (par exemple, avec un pansement VAC ou une fermeture par film plastique).
Pourquoi ?
Une chirurgie prolongée > 1 h 30 favorise l’hypothermie et la fuite liquidienne, ce qui concours à aggraver les triade létale :
Hypothermie (exposition des viscères et baisse du métabolisme par l’anesthésie),
L’hypotension ⇒ diminution de la perfusion → acidose lactique
Un remplissage incontrôlé par des cristalloïdes favorise les troubles de la coagulation (par dilution des facteurs de la coagulation), il en va de même de l’hypothermie et de l’acidose.
Pour qui ?
Patients en acidose métabolique sévère (pH < 7,20 ; Lactates > 5 mmol/L) en hypothermie (t° < 34°C) et qui présente une coagulopathie (TP < 50 % ; fibrinogène < 1,5 g/L ; thrombopénie < 50 000 /ml)
Le Damage Control resuscitation = Damage Control en réanimation est une approche visant à soutenir les fonctions vitales tout en optimisant la réponse physiologique. Elle repose sur les principes suivants :
Restaurer la volémie :
Limitation des cristalloïdes pour éviter la dilution des facteurs de coagulation : 20 ml/kg de solution saline, de Ringer Lactate ou mieux Isofundine (= soluté balancé pour éviter l’acidose hyperchlorémique).
→ cliquer sur ce lien pour plus d’infos sur les solutés de perfusion
Utilisation précoce de produits sanguins en cas de pertes sanguines importantes (10 à 15 ml/kg en CGR pour corriger l’hématocrite et restaurer l’oxygénation).
→ cliquer sur ce lien pour plus d’infos sur la transfusion
Si transfusion massive utiliser un ratio équilibré de 1:1:1 (globules rouges, plasma, plaquettes).
- 15 ml/kg pour le PFC
- 1 Concentré Plaquettaire Standard (CPS )pour 5 kg pour corriger la thrombopénie (en dessous de 50 000/ml)
Administration ciblée de solutions spécifiques (ex. : calcium pour la coagulation).
Prévention et correction de la triade létale
- Hypothermie : Réchauffement actif avec des couvertures chauffantes + dispositifs de réchauffement sanguin.
- Acidose métabolique : Amélioration de la perfusion tissulaire par optimisation du débit cardiaque et oxygénation (bicarbonates en cas d’acidose sévère réfractaire).
- Coagulopathie : transfusion de Plasma Frais Congelé (contient les facteurs de la coagulation), Concentré de Complexe Prothrombinique (hémorragie sous AVK), de cryoprécipités (fibrinogène) et concentrés plaquettaires.
Concentré de Complexe Prothrombinique (CCP) corrige rapidement l’INR en cas de saignement sous AVK à la dose de 25 – 50 UI/kg, l’injection de vitamine K prends le relais plus tardivement.
Acide tranexamique (antifibrinolytique) : 1 g IV sur 10 minutes, suivi de 1 g en perfusion sur 8 heures. Doit être administré dans les 3 premières heures après le début du choc pour être efficace.
Surveillance et correction des paramètres de la coagulation (ex. : TCA, INR, fibrinogène).
Fibrinogène (3 – 4 g IV) si taux < 1,5 g/L.
Calcium (hypocalcémie secondaire à la transfusion massive) : 1 à 2 g de gluconate de calcium IV pour maintenir une calcémie ionisée > 0,9 mmol/L.
Contrôle de la pression artérielle
Hypotension permissive : Maintien d’une pression artérielle systolique autour de 80-90 mmHg pour limiter la perte de sang jusqu’au contrôle chirurgical définitif (sauf en cas de traumatisme crânien associé) avec un recours précoces aux amines pressives : noradrénaline 0,5 mg/h ou 0,1 µg/kg/min.
Optimisation de l’oxygénation
– Maintenir une SpO2 > 94% grâce à un apport d’oxygène ou une ventilation assistée
(Attention au risque d’hypotension lors de la mise en route d’une ventilation assistée par baisse du retour veineux, le recours aux vasopresseurs est courant dans cette situation).
– Surveiller le lactate sanguin et la ScvO₂ (= saturation veineuse centrale en oxygène) pour évaluer la perfusion tissulaire.
La reprise chirurgicale dépend de la stabilisation physiologique du patient et suit la stratégie de Damage Control :
La durée en réanimation avant reprise est de 12 à 48 heures en moyenne (variable selon l’état du patient).
La reprise est planifiée lorsque le patient est stabilisé sur les plans hémodynamique, métabolique (acidose corrigée), et thermique (température corporelle > 35°C).
Critères pour reprendre la chirurgie définitive :
- Absence d’acidose sévère (lactate normalisé ou en baisse significative).
- Absence de coagulopathie majeure.
- Correction de l’hypothermie.
Quels examens en urgence ?
Pour confirmer le diagnostic de choc hémorragique, quantifier la perte sanguine et apprécier sa gravité.
La NFS confirme le diagnostic et permet d’évaluer la profondeur de l’anémie et de quantifier la perte sanguine (dans une certaine mesure car l’anémie apparait tardivement suite à la compensation de la volémie par la perfusion de solutés cristalloïdes ou aux transferts liquidiens d’autres secteurs, qui ne sont pas instantanés).
C’est une notion importante à garder en tête pour interpréter une NFS dans le contexte de l’urgence, l’anémie est souvent sous-estimé !
Les GDS artériel avec lactate et calcémie ionisée (une hypocalcémie ionisée doit être corrigée pour assurer une coagulation efficace) permet d’apprécier la gravité du choc hémorragique (taux d’hémoglobine obtenu rapidement + taux de lactates qui affirme l’état de choc, surtout si associé à une acidose).
Même un prélèvement veineux est accepté vu que ce qui est attendu de cet examen dans cette situation est le taux d’hémoglobine et des lactates (qui sont identiques en veineux ou en artériel) ± pH (légèrement plus bas en veineux).
L’acidose lactique est due à l’hypoperfusion tissulaire en lien avec le choc.
Pour apprécier le retentissement et l’intensité de la coagulopathie de consommation et guider l’administration des produits sanguins labiles (PFC, fibrinogène).
Dès la prise en charge pour anticiper une éventuelle transfusion.
RAI = Recherche des Agglutinines Irrégulières (qui sont importantes surtout chez les poly transfusés)
Raisonnement étiologique
Pour identifier l’origine du choc hémorragique.
Première étape
L’association anémie aiguë + tachycardie + hypotension est en faveur d’un choc hémorragique.
Si le saignement est extériorisé ⇒ compression ou mise en place d’un garrot (bien noter l’heure de pose, sachant qu’une fois posé il ne peut être enlevé qu’en milieu spécialisé à cause du risque de crush syndrome).
Deuxième étape
Si pas de saignement extériorisé, il faut rechercher une étiologie qui pourrait expliquer l’état de choc selon le contexte :
- si traumatisme à haute vélocité ⇒ rechercher une rupture d’organe plein (foie, rein, rate), de gros vaisseaux, un hémothorax ou des fractures d’os longs (bassin/fémur)
- si pas de notion de traumatisme, rechercher un hématome profond (psoas, iliaque), un anévrysme aortique rompu ou une GEU rompue chez la femme en âge de procréer
- si contexte opératoire ⇒ saignement postopératoire jusqu’à preuve du contraire.
Points de vigilance
- La tachycardie peut être absente ou fruste chez la personne âgée ou sous traitement bradycardisant (béta bloquant),
- L’hypotension artérielle est de survenue tardive chez le sujet jeune,
- Certaines hémorragies sont rarement la cause d’un choc (épistaxis et hémoptysies),
- L’origine d’un choc hémorragique en postopératoire est chirurgicale jusqu’à preuve du contraire
- L’absence d’anémie à la NFS n’élimine pas formellement le diagnostic de choc hémorragique

Vous devez être connecté pour poster un commentaire.