Mis à jour : mars 2022
Tout ce qu’il faut savoir sur le SARS-COV2 et la COVID-19 : les traitements autorisés, expérimentaux et la vaccination
Cet article se veut un tour d’horizon sur tous les moyens utilisés contre la COVID-19 dans le monde par différents experts.
CES INFORMATIONS NE SONT PAS DESTINÉES À L’AUTOMÉDICATION
Il appartient à chaque médecin d’adapter et d’appliquer ce qui lui conviens sous sa propre responsabilité.
Ce site diffuse des informations provenant de différentes équipes spécialisées dans le traitement de la COVID-19 dans le monde (en précisant à chaque fois la source) et décline par conséquent toute responsabilité concernant l’utilisation des informations mises à disposition.
Cliquer sur la vidéo pour parcourir rapidement les titres de cet article
Après plus d’un an de COVID-19 on remarque une pluralité de prise en charge et de politique de santés publique.
Des traitements prometteurs se sont montré inefficaces voir dangereux et des traitements inattendus semblent montrer une grande efficacité.
Cette crise a aussi permis des progrès spectaculaires dans les technologies vaccinales
Exemple de prise en charge
Préconisations pour la prise en charge d'un patient présentant une pneumopathie hypoxémiante à SARS-COV-2 (standard de soins)
(protocole récupéré d’un établissement de santé marseillais : mai 2021)
Ce sont des préconisations synthétiques que l’on pourrait qualifier de standard de soins, loin de tout conflit (the standard of care) auquel on compare les autres possibilités thérapeutiques.
Biologie:
NFS, TP, TCA, ionogramme, urée, créatinémie, albumine, ASAT,ALAT, PAL, GGT, CRP, Ferritine, Fibrinogène, D-Dimères, HbA1c
Si anémie : B9, B12, TSH, fer, CST
ECG
A faire en fonction de l’évolution, a minima J3 et la veille de la sortie.
Les PCR COVID 19 doivent être faites systématiquement à J3-J6-J9 et 48h avant une sortie envisagée.
Pas d’antibiothérapie systématique pour la prise en charge thérapeutique initiale d’une pneumonie à SARS-COV2.
Prescription antibiotique en fonction de la gravité et/ou purulence des expectorations pour une durée totale de 5 jours après une ré-évaluation à J3 de l’instauration de l’antibiothérapie :
Ceftriaxone 2g IV 5 jours et Azithromycine 500 mg à J1 puis 250 mg pendant 4 jours.
En cas d’hypersensibilité immuno-allergique aux béta-lactamines : Levofloxacine 400 mg x 2 pendant 7 jours.
En cas de pneumonie acquise pendant l’hospitalisation et les situations où les patients ont déjà reçu un traitement antibiotique probabiliste par béta-lactamines en ambulatoire ou pendant les premiers jours d’hospitalisation : Tazocilline 4g x3 pendant 7 jours.
Lovenox 4000UI/24H en SC
Calciparine 0.2 ml x2/24H en SC Si cl créat <30 sans contrôler le TCA
Lovenox 4000UI x2/24H en SC (si IMC ≥ 30 kg/m²)
Calciparine 0.2 ml x3/24H en SC Si cl créat <30 sans contrôler le TCA
Lovenox 6000UI x2/24H en SC (si poids 120 > kg ou FDR)
Calciparine 0.2 ml x3/24H en SC Si cl créat <30 sans contrôler le TCA
FDR : cancer actif, antécédent personnel de thrombose
Lovenox dose curative 100 UI/Kg x2 /24H (sans dépasser 10000UI/12H) + surveillance activité anti Xa pour éviter un surdosage
Calciparine 500 UI /kg /24H en 3 injections Si Cl créat <30 ml/min (cible = 1,5 < TCA <3)
prélever 4h après l’injection et surveillance TCA quotidienne
- Si Embolie pulmonaire ou TVP
- Si Syndrome inflammatoire marqué (fibrinogène >8 g/l) ou hypercoagulabilité (d-dimères)
Relayer les traitements anticoagulants oraux par héparinothérapie curative
Anticoagulation au minimum préventive simple pendant toute la durée d’hospitalisation. Desescalade vers une posologie préventive standard pour les patients passant d’une unité de soins critiques à notre service, ou n’ayant plus besoin d’oxygénothérapie à haut débit, ou diminution du syndrome inflammatoire.
Anticoagulation à doses préventives en sortie d’hospitalisation d’une durée de 10 jours
(durée à ré-évaluer en fonction des données de la littérature)
Dans tous les cas, toujours évaluer régulièrement la balance bénéfice risque.
En cas de thrombopénie < 50 G/L, arrêt des traitements anticoagulants.
La Dexaméthasone doit être prescrite chez tout patient COVID+ (sans limite d’âge) hospitalisé pour une pneumopathie hypoxémiante requérant une oxygénothérapie (débit ≥ 1 L/min)
On ne retient pas d’indication de la Dexaméthasone en l’absence d’oxygénothérapie.
Posologie : 6 mg/ j
Voie d’administration : voie intra-veineuse
Durée : 10 jours maximum (5 jours minimum, arrêt 24h après sevrage O2)
En cas de sortie avant la fin de la corticothérapie, la Prednisolone (Solupred) à la posologie de 40 mg/j peut être utilisée.
Certains déconseillent l’utilisation des corticoïdes en présence d’une infection non contrôlée (dans le cas du SARS-COV-2 quant le CT qPCR < 30)
Ou hyperleucocytose à PNN (témoignant d’une infection bactérienne active)
Prise en charge de l’insuffisance respiratoire aigüe liée au COVID 19
- Débuter oxygénothérapie si SpO2 < 93%
- Augmenter le débit jusqu’aux objectifs de saturation entre 94 et 96% (sauf BPCO entre 88 et 92%)
- En cas de cible non atteinte avec oxygénothérapie à 6L/min :
- Augmenter le débit au masque moyenne concentration, puis masque à haute concentration jusqu’à 15L/min
- Appel de la réanimation
- Discuter OHD (après avis de la réanimation ou limitations thérapeutiques connues)
Evaluer le score de fragilité pour tous les patients ≥ 65 ans. Rechercher l’existence de directives anticipées.
Evaluation réa nécessaire si au moins 1 des paramètres suivants :
– FR > 25 sous oxygène quel que soit le débit
– SpO2 ≤ 96 % sous O2 ≥ 6L/min ou augmentation rapide des besoins en oxygène
– Delirium, Altération vigilance
– PAS ≤ 100 mm Hg et ou FC ≥ 130/min
A domicile :
2 PCR négatives, sevrage en O2 dans la mesure du possible ± O2 de déambulation selon test de marche.
En cas de sortie sous O2,
ré-évaluation indispensable en consultation à 1 mois.
Sortie possible avec PCR positive uniquement si possibilité d’isolement strict à domicile (veillez à ce que le patient sorte avec une ordonnance de masques).
Dans un autre service : 2 PCR négatives
Pas de ré-évaluation : si pneumopathie à COVID modérée < 50% avec sevrage de l’oxygénothérapie en hospitalisation.
Consultation : à 1 mois chez les patients sortis avec oxygéno-dépendance
Traitements et protocoles utilisés contre la COVID-19 dans le monde
Dans la communication de l’OMS et de certains gouvernements on retrouve les affirmations :
- Il n’y a actuellement aucun traitement efficace contre la COVID-19
- Seul le vaccin est efficace contre les formes graves
Comment faire face à un patient contaminé par le SARS-COV2 ?
Lui dire qu’on a pas de traitement à lui proposer et de rentrer chez lui,
de prendre du paracétamol et d’attendre la guérison et appeler le SAMU en cas d’aggravation ?
Dans la pratique de nombreuses équipes dans le monde ont développés des protocoles thérapeutiques ambulatoires précoces pour éviter l’hospitalisation et des protocoles pour les personnes hospitalisées qui leurs ont permis de soigner des milliers de personnes.
Certains ont même élaborés des protocoles préventifs pour les personnes à haut risque ou après exposition à la COVID‑19
Que nous présenterons selon leurs sources
(et sous la responsabilité de leurs auteurs)
INFORMATION IMPORTANTE
Les médecins hospitalo-universitaires de l’IHU Méditerranée Infection ne font pas de recommandations. Ils décrivent et partagent leur expérience de soin chez des patients informés dans le cadre d’une relation médecin-patient, et des résultats de leur travaux de recherche, de leurs études observationnelles et de leur analyse de la littérature.
Auteurs : Matthieu MILLION, Hervé TISSOT-DUPONT, Laurence CAMOIN, Jean-Christophe LAGIER, Philippe PAROLA, Philippe BROUQUI, Didier RAOULT
Grandes lignes de la présentation
- Comment éliminer une détresse vitale ?
- Indications d’hospitalisation
- Bilan si pas d’hospitalisation
- Traitements
- Suivi
2 février 2021 - 24 min 45"
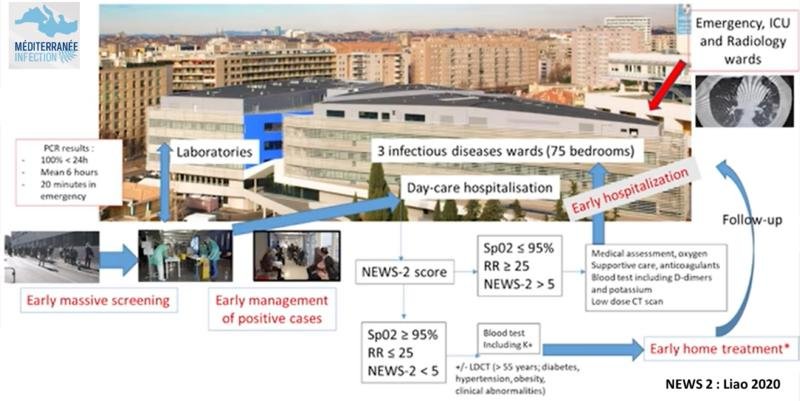
Mesure des constantes vitales :
SpO2, fréquence respiratoire (FR), pouls, tension artérielle (TA), température (t°)
(matériel utilisé à l’IHU : Rad-97®, MASIMO® – cet appareil mesure la fréquence respiratoire automatiquement).
Score News ≥ 5 ⇒ hospitalisation systématique.
Si saturation < 95% ou fréquence respiratoire > 25
patient immédiatement installé dans un lit + gazométrie artérielle, + Oxygène pour SpO2 ≥ 95% puis appel du médecin par l’infirmière.
Score de NEWS-2 (National Early Warning Score) est un score qui permet de stratifier le risque et permet d’améliorer l’identification, le suivi et la prise en charge des patients hospitalisés (crée en 2012 et modifié en 2017)
Stratification des patients :
NEWS-2 < 5 = score bas
NEWS-2 ≥ 5 = score moyen ⇒ Hospitalisation
NEWS-2 ≥ 7 = score élevé ⇒ Hospitalisation
- Score News ≥ 5 ⇒ hospitalisation systématique.
- SpO2 < 95%
- FR > 25 /min
- toute suspicion de surinfection (fièvre élevée ≥ 39.5°C, foyer auscultatoire, CRP élevée, polynucléaires neutrophiles élevés, scanner avec condensation).
- Pas d’autre antibiotique que l’azithromycine en externe.
- toute suspicion de thrombose n’ayant pu être éliminée lors de la prise en charge ambulatoire (phlébite, embolie pulmonaire,…).
- Kaliémie rapide en point-of-care (résultats en 20 min).
- NFS
- D-Dimères
- ECG avec mesure du QTc
- Scanner thoracique low-dose :
- Indication de terrain (Age > 60 ans, Diabète, hypertension artérielle, obésité, maladie respiratoire, maladie cardiaque et autres définissant un patient « à risque ») et / ou clinique (dyspnée, foyer auscultatoire, signe pulmonaire).
(résumé du traitement présenté plus en détail sur le document disponible sous le lien suivant)
1. HYDROXYCHLOROQUINE 200 mg fois 3 par jour pendant 10 jours pendant le repas. (sauf contre-indication : recharge en K+ avant traitement en cas d’hypo K et avis cardiologique sur QT long ou ECG perturbé)
2. ZITHROMAX 250 mg 2 cp le premier jour puis 1 cp par jour pendant 4 jours soit 5 jours au total pendant le repas
Contre-indication la plus fréquente : allergie aux macrolides, co-médication avec la COLCHICINE.
Emergence de l’évidence de l’intérêt de l’utilisation hors AMM de l’ivermectine chez nos patients contre indiqués à HCQ + AZ.
3. RUBOZINC 15 mg 3 par jour pendant 10 jours à distance des repas avec un grand verre d’eau (10h, 16h et 22h).
Contre-indication la plus fréquente : grossesse au premier trimestre.
4. ENOXAPARINE 0,4 mL SC par jour (0,6 mL SC par jour si indice de masse corporelle (IMC) > 30)
Plus d’info …
Systématique d’emblée si et seulement si :
- Age >70 ans
- Obésité (IMC > 30)
- Cancer en cours de traitement ou antécédent de cancer
- Antécédents de maladie thrombo-embolique (phlébite, embolie pulmonaire)
- Antécédent de chirurgie majeure < 3 mois
- Maladie auto-immune : Thyroidite – Lupus – Polyarthrite rhumatoide – Spondylarthrite …
- Hémoglobinopathies sévères : Thalassémie – Drépanocytose
Maladie de Crohn – Rectocolite Hémorragique
Indication médicale au cas par cas, décision du clinicien lors de la consultation:
- Alitement prolongé
- Postpartum si alitement prolongé ou hémorragie de la délivrance
Contraception orale: à discuter au cas par cas (surtout si association à tabac) - Autre facteur(s) considéré (s) comme facteur(s) de risque par le clinicien, notamment accumulation de facteurs de risque cardiovasculaires.
Administration par infirmière au domicile avec surveillance quotidienne de la saturation.
Chez les patients avec une pneumopathie documentée au scanner très inflammatoire (CRP > 100mg/L) quand charge virale basse (CT qPCR ≥ 30), ou au cas par cas, une corticothérapie basse dose (dexaméthasone 6 mg/j) sera proposée en hospitalisation conventionnelle en association à des antibiotiques à large spectre.
Chez les patients en détresse respiratoire malgré 15 L/min d’oxygène (masque à haute concentration) et contre-indiqués à la réanimation, une oxygénothérapie haut débit (machine utilisée à l’IHU : Optiflow®Nasal High Flow) pourra être proposée en absence de contre-indications (hypercapnie) et sauve 30% de ces patients.
Ordonnance pour prise de la SpO2 quotidienne pendant 10 jours pour tous les patients à risque (âge > 60 ans, obésité, hypertension artérielle, diabète, facteurs de risque de thrombose, maladie chronique autre…).
- Saturomètre digital en vente libre en pharmacie.
- Montre intelligente connectée (matériel utilisée à l’IHU : SmartWatch android, Withings ScanWatch – autre matériel utilisable : AppleWatch) avec électrocardiogramme et mesure du QTc (ECG) et saturation pulsée en oxygène (SpO2)
Consignes pour revenir en cas de :
– Intolérance du traitement
– Dyspnée
– Saturation en oxygène ≤ 95%
– QTc anormal
– Tout autre problème (au moindre doute)
Rééducation immédiate de l’anosmie
En suivant tutoriel fait par l’équipe du Pr MICHEL « J’ai perdu le goût et l’odorat : concrètement que faire »
Des corticoïdes par voie nasale sont suceptible d’améliorer les symptômes à ce niveau.
Test PCR entre J7 et J10 pour évaluer la persistance de la contagion.
En absence d’aggravation, suivi assuré par le médecin traitant.
Si persistance de symptômes, notamment ORL (anosmie), neurologiques ou respiratoire, reconsultation dans un centre spécialisé des séquelles du Covid.
Lien vers protocole patient hospitalisés
(Eng. version)
« Dans notre cohorte ambulatoire, nous avons récemment rapporté un taux de mortalité de 0,15% parmi les 10 429 patients suivis et un taux de mortalité de 0,06 % parmi les 8 315 patients traités par HCQ-AZ (17). »
10 juin 2021 - 17 min 45
Association d’HCQ (200 mg d’HCQ par voie orale, x3/j pendant dix jours) et d’AZ (500 mg le jour 1 suivis de 250 mg par jour pendant les quatre jours suivants).
Comme détaillé précédemment (17, 18), les patients ont été informés de la nature hors AMM de la prescription d’HCQ et d’AZ avant de recevoir le traitement. Tous les patients ont subi une analyse électrolytique et un électrocardiogramme (ECG) avec mesure du QT corrigé (formule de Bazett) avant de commencer le traitement. Les ECG présentant des anomalies étaient systématiquement adressés à un cardiologue pour une évaluation plus approfondie.
A partir du 15 avril, nous avons ajouté la prescription de zinc élémentaire (15 mg, x3/j pendant 10 jours).
De plus, des antibiotiques à large spectre (ceftriaxone ou ertapénème) ont été inclus dans le schéma thérapeutique des patients atteints de pneumonie et/ou de scores NEWS ≥ 5.
Depuis le 5 avril 2020, s’ils ne présentaient aucune contre-indication, tous les patients étaient traités par un agent anticoagulant.
La posologie de l’anticoagulant a été décidée selon les recommandations de la Société française d’anesthésie et de réanimation (26), avec stratification selon le niveau d’administration d’oxygène, le poids du patient, les D-dimères et le fibrinogène.
Posologie :
Pour les patients ayant un IMC < 30 kg/m2, ⇒ énoxaparine 4000 UI / jour.
Si IMC > 30 kg/m2, ou si OHD ⇒ énoxaparine 4000 UI x2 / j ou 6000 UI x2 / j.
En cas d’hypercoagulabilité marquée par des D Dimères > 3 g/mL ou de fibrinogène > 8 g/L, avons ⇒ tinzaparine 175 UI/kg/j ou énoxaparine 100 UI/kg x2/j (quel que soit le poids ou le niveau d’administration d’oxygène) .
En cas d’insuffisance rénale, de l’héparine sodique ou calcique a été utilisée.
Si les patients recevaient déjà un traitement anticoagulant à l’admission, le traitement était poursuivi ou ajusté pour l’héparine, selon les recommandations du clinicien responsable (26).
Les soins standard comprenaient une supplémentation systématique en oxygène.
Enfin, à partir du 15 septembre 2020, chez les patients en détresse respiratoire malgré 15 L/min d’oxygène (masque à haute concentration) qui n’étaient pas éligibles aux soins intensifs en raison de leur âge et/ou de leurs comorbidités (et pour lesquels le transfert en réanimation n’était pas possible) une oxygénothérapie haut débit a pu être proposée en absence de contre-indications (hypercapnie) et a sauvé 30% de ces patients.
À partir de juin 2020, dexaméthasone 6 mg / 10 jours, pour les patients en dehors de la phase aiguë de la maladie qui avaient besoin d’une augmentation de l’oxygène.
Séminaire McCullough (29/06/2021)
Séminaire McCullough
à l’IHU Marseille Méditerranée
(22 min)
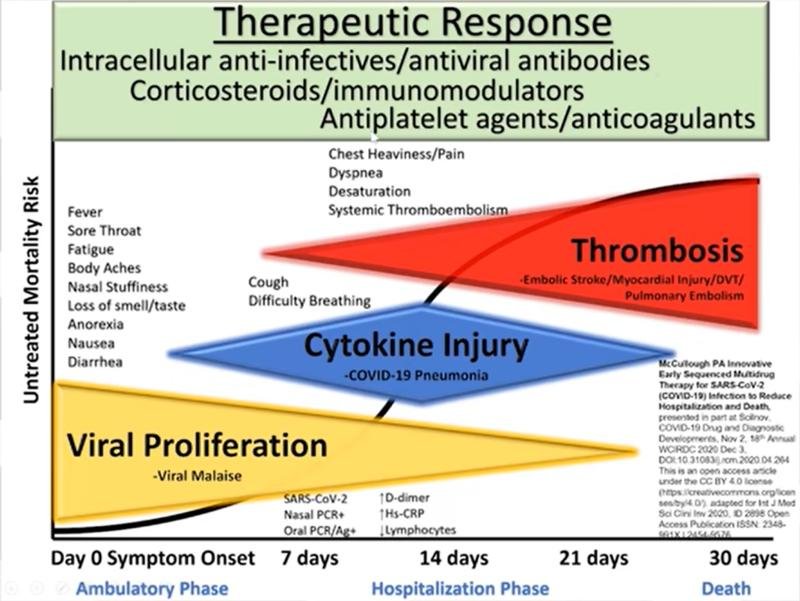
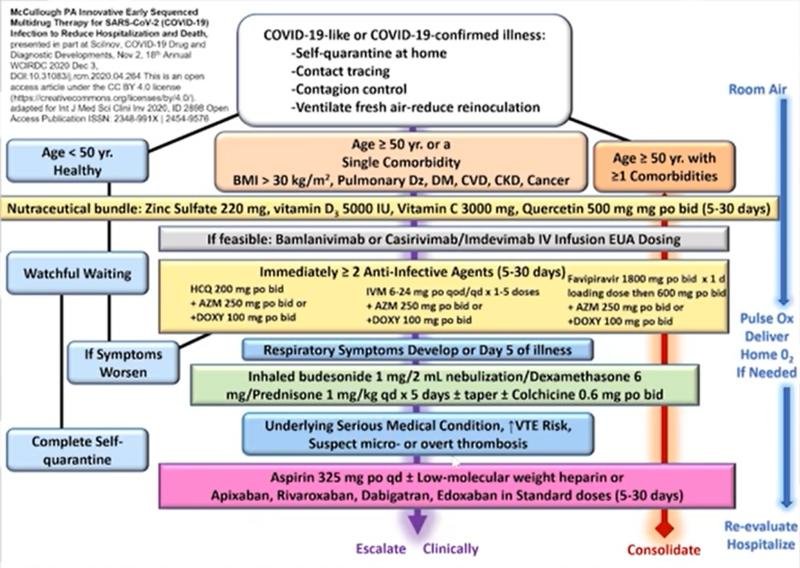
Bases physiopathologiques et justification clinique du traitement ambulatoire précoce de la COVID-19
Grandes lignes
Approche Thérapeutique pluri médicamenteuse précoce séquencée
Il s’agit d’une combinaison de plusieurs médicaments que le médecin peut utiliser en fonction de la stratification du risque mais qu’il doit adapter à chaque patient, il ne s’agit pas d’utiliser tous ces médicaments pour tous les patients !
Prise en charge ambulatoire du Covid-19
Quand ?
Le plus tôt possible !
rédigé par : des Médecins, des Pharmaciens, des Docteurs es-sciences du collectif Réinfocovid du 26/06/2021
(Lien vers la version pdf) ou vers le site Reinfocovid
Arbre décisionnel
Mode d'emploi de larbre décisionnel
Syndrome viral avec fièvre modérée, courbatures, fatigues, symptômes ORL ± respiratoires vont évoquer une infection virale potentiellement à SARS-COV-2
⇒ 2 prescriptions immédiates
- ZINC (gluconate ou bisyglinate) à raison de 30 mg matin et soir (+ 30 mg à midi si patient > 80 kg) pour son action antivirale
- Vitamine D : une dose de charge de 50 000 UI, puis 4 000 UI/J pendant au moins 15 jours puis en fonction des besoins et des dosages sériques de la 25 OHD2-D3
+ Faire réaliser un test PCR (ou un test antigénique éventuellement)
Si PCR NEGATIVE
Poursuivre le ZINC 5 jours et on ajoutera un traitement symptomatique et/ou étiologique en fonction du diagnostic retenu.
Une surveillance et un nouveau test PCR en fonction de l’évolution des symptômes peut être envisagé.
Si PCR POSITIVE
et pas de facteurs de risque :
IVERMECTINE à 0,2 mg/kg à J1, J2, J3 et J8 (à prendre pendant les repas) ± traitement symptomatique
si facteurs de risque (de faire une forme grave) :
IVERMECTINE à 0,2 mg/kg pendant 5 jours puis une dose à J8
+ AZITHROMYCINE cp 250 mg (2 cp à J1 puis 1 cp les 4 jours suivants) ou CLARITHROMYCINE cp 500 mg (1 cp matin et soir pendant 7 jours) ou DOXYCYCLINE cp 100 mg (1 cp matin et soir pendant 7 jours) ± BUDESONIDE 400 µg matin et soir (x2 si fragilité respiratoire)
Surveillance SpO2
(L’HCQ peut être une alternative à l’ivermectine mais présente des précautions d’emploie qui font préférer l’ivermectine en 1e intention)
HCQ = hydroxychloroquine
- Age > 65 ans
- Obésité (IMC > 30)
- Diabète (mal équilibré)
- HTA (mal équilibrée)
- affection respiratoire chronique
- Insuffisance rénale chronique
- Sujet immunodéprimé
Si amélioration clinique
un simple traitement symptomatique pourra être poursuivi au-delà du 7e jours avec surveillance de la SpO2 et consultation à la moindre aggravation jusqu’à J14
Si les symptômes ne s’améliorent pas ou s’aggravent
⇒ idem traitement du patient avec comorbidité :
IVERMECTINE à 0,2 mg/kg pendant 5 jours puis une dose à J8
+ AZITHROMYCINE cp 250 mg (2 cp à J1 puis 1 cp les 4 jours suivants) ou CLARITHROMYCINE cp 500 mg (1 cp matin et soir pendant 7 jours) ou DOXYCYCLINE cp 100 mg (1 cp matin et soir pendant 7 jours) ± BUDESONIDE 400 µg matin et soir (x2 si fragilité respiratoire)
Surveillance SpO2
(L’HCQ peut être une alternative à l’ivermectine mais présente des précautions d’emploie qui font préférer l’ivermectine en 1e intention)
Persistance des symptômes au-delà du 7e jour ou
patient vu à J8 avec symptômes et PCR POSITIVE
⇒ BILAN BIOLOGIQUE
- NFS (inversion de formule avec PNN bas ⇒ infection virale.
↑ GB avec ↑ PNN ⇒ surinfection bactérienne) - CRP et LDH (évaluer la gravité de l’inflammation)
- D-DIMERES (permet de suspecter des micro thromboses = principale complication de la 2e phase de la maladie)
- PCT (pour évaluer la présence d’une surinfection bactérienne)
à compléter éventuellement par :
- TDM (pour évaluer l’étendu des lésions pulmonaires en verre dépoli)
- bilan de thrombose et d’embolie pulmonaire (si ↑↑ des D-dimères)
- Gaz du sang
D-dimères dans la norme sans signe de surinfection ni de thrombose :
- ajouter aspirine 75 à 100 mg/j
- poursuivre budésonide et l’antibiothérapie associée à l’ivermectine en fonction des symptômes
- traitement symptomatique
En cas de surinfection bactérienne :
modifier ou compléter l’antibiothérapie (Amoxicilline / Ac clavulanique)
En cas de bilan évoquant la 2e phase de la COVID avec micro thrombose et orage cytokinique ⇒ prescrire pour 1 semaine minimum :
- anticoagulant à dose préventive (HBPM ou inhibiteur Anti-Xa)
- Corticothérapie (en moyenne Dexaméthasone 6 mg ou prédnisolone 0,5 mk/kg/j) pendant 6 jours minimum
- poursuivre : antibiotique + ivermectine + budésonide (ou remplacer ivermectine par HCQ à raison de 200 mg x2/J pendant 6 jours du fait de son action sur le système immunitaire).
Ajouter éventuellement ;
- oxygène à domicile
- anti histaminique (Loratadine)
Réévaluer régulièrement la situation et les critères nécessitants de déclencher l’hospitalisation
Médicaments proposés
Hydroxychloroquine (HCQ)
L’effet antiviral de la chloroquine et de ses dérivés (HCQ) contre le SARS-CoV-2 a été identifié dès février 2020 par des études in vitro dans les premières publications chinoises [65,66] et un essai préliminaire en France [67].
L’effet antiviral synergique in vitro de l’association de HCQ et d’azithromycine (AZ) a également été signalé [68].
De plus, HCQ possède plusieurs propriétés anti-inflammatoires et antithrombotiques [69], ce qui est particulièrement intéressant dans le contexte de l’inflammation et de la coagulopathie associées au Covid-19.
Les premiers essais ont été réalisés en Chine par Gao et al. En se référant à 15 études ils déduisent un bénéfice du traitement par hydroxychloroquine par diminution des exacerbations pulmonaires, améliorations de l’imagerie pulmonaire, facilitant la clairance du virus et réduisant la durée de la maladie à Covid-19 chez plus de 100 patients [70].
Les chercheurs français P. Gautret et D. Raoult, s’intéressent ensuite à cette molécule dans le traitement précoce de la Covid-19 et rapportent un effet de l’association HCQ + Azithromycine avec diminution de la charge virale et élimination du virus par rapport au groupe contrôle. Cette étude a été vivement critiquée car elle n’était pas randomisée en double aveugle [67].
Pourquoi la chloroquine, mécanisme d'action ...
Est-ce que l'HCQ n'est efficace qu'à Marseille ?
Azithromycine
Macrolide connu depuis longtemps et très utilisé dans le traitement des pneumonies, efficace contre les bactéries à gram + et à gram – ainsi que sur les bactéries intracellulaires.
Il a la particularité de se concentrer dans certains types de cellules telles que les macrophages [85].
Possède aussi des propriétés antivirales attribuées à la réduction du transfert endosomal des virions ainsi qu’à des effets anti-inflammatoires établis [86].
D’autre part, il pourrait prévenir les surinfections bactériennes du poumon dans le cadre de l’infection à SARS-CoV-2.
Études montrant une activité anti-SARS-CoV-2 de l’azithromycine chez l’homme
Gautret et al. suggèrent, dans une étude observationnelle, un effet synergique entre l’azithromycine et l’hydroxychloroquine qui permettait de négativer à J6 la charge virale mesurée par RT-PCR chez 100% des patients ayant reçu la bithérapie (n=6) contre 57% ayant reçu l’hydroxychloroquine seule (n=14) et seulement 12% pour ceux ne recevant que des soins standards (n=16). Ces différences étaient significatives (p=0.001) [67].
L’équipe marseillaise a continué son étude observationnelle en incluant 1061 patients qui ont reçu de manière précoce HCQ-AZ. La majorité des patients ainsi traités ont eu une forme modérée de la maladie pour 95% d’entre eux. Seulement 0.9% des patients ont été transférés en soins intensifs et seulement 0.9% des patients sont décédés [97].
Lagier et al. rapportent rétrospectivement la prise en charge clinique de 3737 patients Sars-Cov-2 positifs, dont 3119 (83,5%) traités par HCQ-AZ (200 mg de hydroxychloroquine par voie orale, x3 / jour pendant 10 J et 500 mg d’azithromycine par voie orale au jour 1 suivis de 250 mg par jour pendant les 4 jours suivants, respectivement) pendant au moins trois jours et 618 (16,5%) patients traités avec des soins standards. L’association HCQ-AZ était associée significativement avec une diminution du risque de transfert en soins intensifs, du risque de passer plus de 10 jours hospitalisés, ainsi qu’une clairance virale plus rapide [98].
Cette thérapeutique doit donc être utilisée de façon précoce dans l’histoire de la maladie.
- Liu J, Cao R, Xu M, Wang X, Zhang H, Hu H, et al. Hydroxychloroquine, a less toxic derivative of chloroquine, is effective in inhibiting SARS-CoV-2 infection in vitro. Cell Discov. 2020;6: 16. doi:10.1038/s41421-020-0156-0
- Wang M, Cao R, Zhang L, Yang X, Liu J, Xu M, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res. 2020;30: 269–271. doi:10.1038/s41422-020-0282-0
- Gautret P, Lagier JC, Parola P, Hoang VT, Meddeb L, Mailhe M, et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int J Antimicrob Agents. 2020. doi:10.1016/j.ijantimicag.2020.105949
- Andreani J, Le Bideau M, Duflot I, Jardot P, Rolland C, Boxberger M, et al. In vitro testing of combined hydroxychloroquine and azithromycin on SARS-CoV-2 shows synergistic effect. Microb Pathog. 2020;145: 104228. doi:https://doi.org/10.1016/j.micpath.2020.104228
- Gautret P, Million M, Jarrot P-A, Camoin-Jau L, Colson P, Fenollar F, et al. Natural history of COVID-19 and therapeutic options. Expert Rev Clin Immunol. 2020;16: 1159–1184. doi:10.1080/1744666X.2021.1847640
- Gao J, Tian Z, Yang X. Breakthrough: Chloroquine phosphate has shown apparent efficacy in treatment of COVID-19 associated pneumonia in clinical studies. Biosci Trends. 2020;14: 72–73. doi:10.5582/bst.2020.01047
- Roussel Y, Raoult D. Influence of conflicts of interest on public positions in the COVID-19 era, the case of Gilead Sciences. New microbes new Infect. 2020;38: 100710. doi:10.1016/j.nmni.2020.100710
- Million M, Gautret P, Colson P, Roussel Y, Dubourg G, Chabriere E, et al. Clinical efficacy of chloroquine derivatives in COVID-19 infection: comparative meta-analysis between the big data and the real world. New Microbes New Infect. 2020;38: 100709. doi: https://doi.org/10.1016/j.nmni.2020.100709
- Chen Z, Hu J, Zhang Z, Jiang S, Han S, Yan D, et al. Efficacy of hydroxychloroquine in patients with COVID-19: results of a randomized clinical trial. medRxiv. 2020; 2020.03.22.20040758. doi:10.1101/2020.03.22.20040758
- Huang M, Tang T, Pang P, Li M, Ma R, Lu J, et al. Treating COVID-19 with Chloroquine. J Mol Cell Biol. 2020;12: 322–325. doi:10.1093/jmcb/mjaa014
- Tang W, Cao Z, Han M, Wang Z, Chen J, Sun W, et al. Hydroxychloroquine in patients with mainly mild to moderate coronavirus disease 2019: open label, randomised controlled trial. BMJ. 2020;369: m1849. doi:10.1136/bmj.m1849
- Chen L, Zhang Z-Y, Fu J-G, Feng Z-P, Zhang S-Z, Han Q-Y, et al. Efficacy and safety of chloroquine or hydroxychloroquine in moderate type of COVID-19: a prospective open-label randomized controlled study. medRxiv. 2020; 2020.06.19.20136093. doi:10.1101/2020.06.19.20136093
- Mitjà O, Corbacho-Monné M, Ubals M, Alemany A, Suñer C, Tebé C, et al. A Cluster-Randomized Trial of Hydroxychloroquine for Prevention of Covid-19. N Engl J Med. 2020;384: 417–427. doi:10.1056/NEJMoa2021801
- Guérin V, Lévy P, Thomas J-L, Lardenois T, Lacrosse P, Sarrazin E, et al. Azithromycin and Hydroxychloroquine Accelerate Recovery of Outpatients with Mild/Moderate COVID-19. Asian J Med Heal. 2020;18: 45–55. doi:10.9734/ajmah/2020/v18i730224
- Hong KS, Jang JG, Hur J, Lee JH, Kim HN, Lee W, et al. Early Hydroxychloroquine Administration for Rapid Severe Acute Respiratory Syndrome Coronavirus 2 Eradication. Infect Chemother. 2020;52: 396–402. Available: https://doi.org/10.3947/ic.2020.52.3.396
- Bernabeu-Wittel M, Ternero-Vega JE, Nieto-Martín MD, Moreno-Gaviño L, Conde-Guzmán C, Delgado-Cuesta J, et al. Effectiveness of a On-site Medicalization Program for Nursing Homes With COVID-19 Outbreaks. Journals Gerontol Ser A. 2021;76: e19–e27. doi:10.1093/gerona/glaa192
- Ip A, Ahn J, Zhou Y, Goy AH, Hansen E, Pecora AL, et al. Hydroxychloroquine in the treatment of outpatients with mildly symptomatic COVID-19: a multi-center observational study. BMC Infect Dis. 2021;21: 72. doi:10.1186/s12879-021-05773-w
- Su Y, Ling Y, Ma Y, Tao L, Miao Q, Shi Q, et al. Efficacy of early hydroxychloroquine treatment in preventing COVID-19 pneumonia aggravation, the experience from Shanghai, China. Biosci Trends. 2020. doi:10.5582/BST.2020.03340
- Mokhtari M, Mohraz M, Gouya MM, Namdari Tabar H, Tabrizi J-S, Tayeri K, et al. Clinical outcomes of patients with mild COVID-19 following treatment with hydroxychloroquine in an outpatient setting. Int Immunopharmacol. 2021;96: 107636. doi: https://doi.org/10.1016/j.intimp.2021.107636
- Million M, LAGIER J-C, TISSOT-DUPONT H, PAROLA P, BROUQUI P, RAOULT D. Early Treatment with Hydroxychloroquine and Azithromycin in 10,429 COVID-19 Outpatients: A Monocentric Retrospective Cohort Study. preprint. 2021;Mai. doi: https://doi.org/10.35088/vadm-jx92
- Venditto VJ, Haydar D, Abdel-Latif A, Gensel JC, Anstead MI, Pitts MG, et al. Immunomodulatory Effects of Azithromycin Revisited: Potential Applications to COVID-19. Front Immunol. 2021;12: 1–19. doi:10.3389/fimmu.2021.574425
- Pani A, Lauriola M, Romandini A, Scaglione F. Macrolides and viral infections: focus on azithromycin in COVID-19 pathology. Int J Antimicrob Agents. 2020;56: 106053. doi:10.1016/j.ijantimicag.2020.106053
- Gielen V, Johnston SL, Edwards MR. Azithromycin induces anti-viral responses in bronchial epithelial cells. Eur Respir J. 2010. doi:10.1183/09031936.00095809
- Asada M, Yoshida M, Suzuki T, Hatachi Y, Sasaki T, Yasuda H, et al. Macrolide antibiotics inhibit respiratory syncytial virus infection in human airway epithelial cells. Antiviral Res. 2009. doi:10.1016/j.antiviral.2009.05.003
- Retallack H, Di Lullo E, Arias C, Knopp KA, Laurie MT, Sandoval-Espinosa C, et al. Zika virus cell tropism in the developing human brain and inhibition by azithromycin. Proc Natl Acad Sci U S A. 2016. doi:10.1073/pnas.1618029113
- Tran DH, Sugamata R, Hirose T, Suzuki S, Noguchi Y, Sugawara A, et al. Azithromycin, a 15-membered macrolide antibiotic, inhibits influenza A(H1N1)pdm09 virus infection by interfering with virus internalization process. J Antibiot (Tokyo). 2019. doi:10.1038/s41429-019-0204-x
- Zeng S, Meng X, Huang Q, Lei N, Zeng L, Jiang X, et al. Spiramycin and azithromycin, safe for administration to children, exert antiviral activity against enterovirus A71 in vitro and in vivo. Int J Antimicrob Agents. 2019. doi:10.1016/j.ijantimicag.2018.12.009
- Tahan F, Ozcan A, Koc N. Clarithromycin in the treatment of RSV bronchiolitis: A double-blind, randomised, placebo-controlled trial. Eur Respir J. 2007. doi:10.1183/09031936.00029206
- Arabi YM, Deeb AM, Al-Hameed F, Mandourah Y, Almekhlafi GA, Sindi AA, et al. Macrolides in critically ill patients with Middle East Respiratory Syndrome. Int J Infect Dis. 2019. doi:10.1016/j.ijid.2019.01.041
- Lee N, Wong CK, Chan MCW, Yeung ESL, Tam WWS, Tsang OTY, et al. Anti-inflammatory effects of adjunctive macrolide treatment in adults hospitalized with influenza: A randomized controlled trial. Antiviral Res. 2017. doi:10.1016/j.antiviral.2017.05.008
- Higashi F, Kubo H, Yasuda H, Nukiwa T, Yamaya M. Additional treatment with clarithromycin reduces fever duration in patients with influenza. Respir Investig. 2014. doi:10.1016/j.resinv.2014.05.001
- Kakeya H, Seki M, Izumikawa K, Kosai K, Morinaga Y, Kurihara S, et al. Efficacy of combination therapy with oseltamivir phosphate and azithromycin for influenza: A multicenter, open-label, randomized study. PLoS One. 2014. doi:10.1371/journal.pone.0091293
- Million M, Lagier JC, Gautret P, Colson P, Fournier PE, Amrane S, et al. Early treatment of COVID-19 patients with hydroxychloroquine and azithromycin: A retrospective analysis of 1061 cases in Marseille, France. Travel Med Infect Dis. 2020. doi:10.1016/j.tmaid.2020.101738
- Lagier JC, Million M, Gautret P, Colson P, Cortaredona S, Giraud-Gatineau A, et al. Outcomes of 3,737 COVID-19 patients treated with hydroxychloroquine/azithromycin and other regimens in Marseille, France: A retrospective analysis. Travel Med Infect Dis. 2020;36. doi:10.1016/j.tmaid.2020.101791
- Molina JM, Delaugerre C, Le Goff J, Mela-Lima B, Ponscarme D, Goldwirt L, et al. No evidence of rapid antiviral clearance or clinical benefit with the combination of hydroxychloroquine and azithromycin in patients with severe COVID-19 infection. Medecine et Maladies Infectieuses. 2020. doi:10.1016/j.medmal.2020.03.006
- Furtado RHM, Berwanger O, Fonseca HA, Corrêa TD, Ferraz LR, Lapa MG, et al. Azithromycin in addition to standard of care versus standard of care alone in the treatment of patients admitted to the hospital with severe COVID-19 in Brazil (COALITION II): a randomised clinical trial. Lancet. 2020. doi:10.1016/S0140-6736(20)31862-6
- Cavalcanti AB, Zampieri FG, Rosa RG, Azevedo LCP, Veiga VC, Avezum A, et al. Hydroxychloroquine with or without Azithromycin in Mild-to-Moderate Covid-19. N Engl J Med. 2020. doi:10.1056/nejmoa2019014
Liste récupérée à partir du document :
Prise en charge ambulatoire du Covid-19
(version pdf) (références uniquement disponibles sur la page)
RETRACTED:
Hydroxychloroquine or chloroquine with or without a macrolide for treatment of COVID-19: a
multinational registry analysis. Prof Mandeep R Mehra, MD; Sapan S Desai, MD; Prof Frank Ruschitzka, MD ;Amit N
Patel, MD; Published:May 22, 2020DOI:https://doi.org/10.1016/S0140-6736(20)31180-6
RETRACTED :
Mehra MR, Desai SS, Kuy S, Henry TD, Patel AN. Cardiovascular disease, drug therapy, and mortality in
Covid-19. N Engl J Med 2020;382:e102-e102.
Plus de 310 études ont été réalisées dont au moins 259 études comparant le traitement du Covid-19 par l’hydroxychloroquine à un groupe contrôle; regroupant 385 000 patients et écrits par plus de 4000 scientifiques différents.
Ces études se sont intéressées à l’effet de l’hydroxychloroquine en :
· Prophylaxie de préexposition :
c’est à dire prise de façon régulière pour empêcher l’infection
· Prophylaxie après exposition :
prise de l’HCQ rapidement après avoir été en contact avec un malade
· Traitement précoce :
prise de l’HCQ le plus rapidement possible après le diagnostic
· Traitement tardif :
prise de l’HCQ lorsque la maladie est déjà évoluée.
Il en ressort que l‘efficacité est notable avec une utilisation plus précoce et un dosage adéquat.
Un traitement précoce montre systématiquement des effets positifs.
Les évaluations négatives ignorent généralement la durée du traitement, se concentrant souvent sur un sous-ensemble d’études de phase tardive.
En résumé de l’ensemble de ces études, il ressort que :
- 100% des 29 études aujourd’hui disponibles sur le traitement précoce font état d’un effet positif (13 sont statistiquement significatives prises isolément).
- 87% des essais contrôlés randomisés (ECR) pour un traitement précoce, la prophylaxie pré ou post-exposition, rapportent des effets positifs.
- Le traitement tardif est moins efficace, avec seulement 70% des 177 études rapportant un effet positif.
- Les traitements très tardifs ne sont pas efficaces et peuvent être nocifs, en particulier lorsqu’ils sont administrés à des doses excessives.
- Aucun effet secondaire sérieux n’a été noté dans ces essais randomisés.
- Une méta-analyse des effets aléatoires avec des effets groupés utilisant le résultat le plus grave rapporté montre une amélioration de 66% pour les 29 études de traitement précoce (RR 0,34 [0,24-0,49]).
- Les résultats sont similaires après une analyse de sensibilité basée sur l’exclusion : 67% (RR 0,33 [0,24-0,44]), et après restriction à 20 études évaluées par des pairs : 65% (RR 0,35 [0,25-0,47]).
- Si l’on se limite aux six ECR, l’amélioration est de 46% (RR 0,54 [0,33-0,86]).
- Si l’on se limite aux 13 résultats de mortalité, on constate une baisse de 75% de la mortalité (RR 0,25 [0,16-0,40]).
- Sites qui compilent les études concernant l’hydroxychloroquine (C19HCQ)
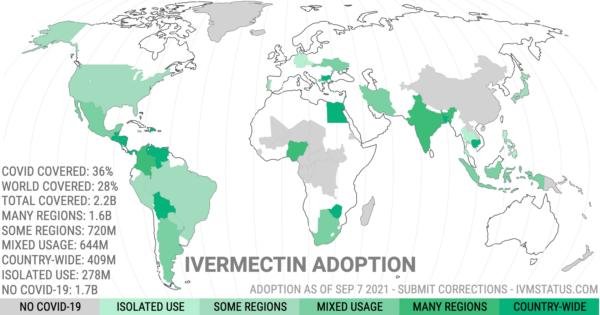
- Page qui récapitule l’Adoption HCQ contre la COVID-19 dans le monde pays par pays
IVERMECTINE
Médicament antiparasitaire, qui possède de fortes propriétés antivirales et anti-inflammatoires.
– réduit l’entrée du virus SARS-CoV-2 dans nos cellules et donc l’infectiosité du virus en se liant à la protéine Spike du Sars-Cov-2 et empêchant ainsi sa liaison avec le récepteur ACE-2 présent à la surface de nos cellules [37].
– réduit la réplication de l’ARN viral du SARS-CoV-2 [38] en interférant avec plusieurs protéines requises pour la réplication du virus [37,39] ainsi que l’enzyme RdRp (SARS-CoV-2 RNA-dependent RNA polymerase) [40].
– empêche le virus de « communiquer » avec le noyau de nos cellules :
La protéine cargo du SARS-CoV-2 se lie à l’Importin (IMP) α/β1 de l’hôte afin de migrer dans le noyau et de réduire la réponse antivirale de la cellule hôte. L’ivermectine interagit directement avec l’IMPα et empêche son interaction avec IMPβ1, empêchant ainsi l’heterodimere Importin α/β1 de se lier à la protéine virale cargo du SARS-CoV-2 et donc son entrée dans le noyau [38,41]. bloque ainsi la reconnaissance du signal de localisation nucléaire (NLS) par le virus.
– exerce également des effets anti-inflammatoires en bloquant la voie inflammatoire NF-kB (le plus puissant médiateur de l’inflammation) et la production de cytokines [42–44] et peut donc réduire la tempête cytokinique associée à la phase tardive de Covid-19.
De nombreuses études contrôlées et d’observation sur l’ivermectine ont révélé de puissants effets antiviraux et anti-inflammatoires et une réduction de la mortalité des patients Covid de 50 à 80%, même dans les cas graves .
- Prévient la transmission et le développement de la maladie Covid-19 chez les personnes exposées à des patients infectés [45–50].
- Accélère la guérison et prévient la détérioration chez les patients présentant une maladie légère à modérée traitée tôt après les symptômes [46,51–55].
- Accélère le rétablissement, permet d’éviter l’admission aux soins intensifs et réduit la mortalité des patients hospitalisés [46,53,56–60].
- Réduit la mortalité chez les patients atteints d’une forme grave de Covid-19 [46,56,58].
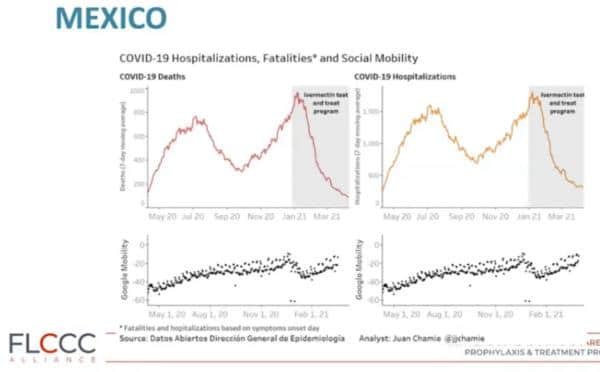
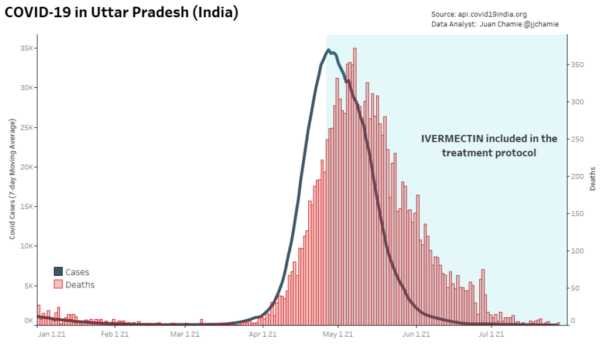
- Entraîne des réductions frappantes des taux de létalité dans les régions où son utilisation est répandue [61].
Une méta-analyse préliminaire de l’OMS a montré que l’ivermectine réduit la mortalité des patients Covid de 75% [62].
Une revue des essais sur l’ivermectine et des données épidémiologiques, concluent que l’ivermectine est efficace pour la prophylaxie et le traitement, et devrait être déployée globalement et systématiquement dans la prévention et le traitement du Covid-19 [63].
Un examen systématique et une méta-analyse de 21 Essais cliniques randomisés concluent à l’efficacité de l’ivermectine en prophylaxie avec une réduction des transmissions de 86% en moyenne, ainsi qu’une de baisse de la mortalité de 68% [64].
Pour accéder à TOUTES les études sur l’ivermectine, voir sur le site C19ivermectine
Pour aller plus loin
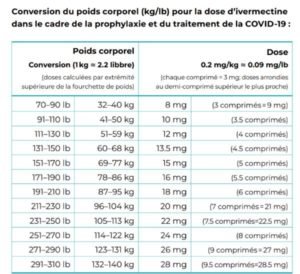
0,2 à 0,4 mg/kg par dose
(à prendre pendant ou après les repas)
Une dose par jour, à prendre pendant 3 à 5 jours ou jusqu’à guérison.
Utiliser la fourchette de dose supérieure si :
1) le patient est dans une région où les variants sont plus agressifs ;
2) le traitement du patient a commencé après le J5 des symptômes ou en phase pulmonaire ;
3) il existe chez le patient des comorbidités/facteurs de risque multiples.
Ne pas utiliser chez la femme enceinte ou allaitante.
L'ivermectine selon l'IHU
Ivermectine : alternative thérapeutique raisonnable contre le SARS-CoV-2 ?
Dr. Pierre Dudouet, IHU Méditerranée Infection.
20 janvier 2021
Ivermectin against SARS-CoV-2
(présenté en français)
Colonel Bruno Pradines, Institut de Recherche Biomédicales des Armées, Service de Santé des Armées, VITROME, IHU.
12 mai 2021
Qu’est ce qu’il en est sur le plan des études ?
Voir le site C19ivermectine
- Ce qui se dit dans la presse (lien vers article de presse)
- Un ancien éditorialiste de la revue prescrire a écrit sur le sujet sur son blog (son blog a disparu maintenant)
Quelques pays où l'ivermectine a été utilisée à grande échelle
Doxycycline
Antibiotique à large spectre qui a des effets synergiques antiviraux et anti-inflammatoires lorsqu’il est associé à l’ivermectine. Ainsi, la doxycycline amortit la tempête de cytokines et prévient les lésions pulmonaires [103].
Comme les patients atteints de Covid-19 ont besoin à la fois d’un traitement antiviral et antiinflammatoire et d’une protection contre les lésions pulmonaires, il est justifié d’étudier la thérapie combinée proposée.
Comme la doxycycline est peu coûteuse et largement disponible, qu’elle présente un profil de tolérance sûr, elle constitue une option attrayante pour le traitement du Covid-19 ainsi que pour soulager potentiellement les séquelles pulmonaires et assurer également une protection contre les pneumonies bactériennes atypiques telles que Mycoplasma pneumoniae et Legionella pneumophilia.
200 mg per os suivi de 100 mg per os 2 fois par jour pendant 5 jours
et peut être étendu à 30 jours en cas de symptômes persistants ou de signes de surinfection bactérienne.
La doxycycline peut être utile avec l’HCQ chez les patients pour lesquels l’association HCQ-AZ n’est pas souhaitée.
Vitamine D
- induit la production des peptides antimicrobiens dans les monocytes et les polynucléaires neutrophiles tels que les défensines et les cathélicidines
- augmente l’expression de la cathélicidine humaine (HCAP-18) impliquée dans la défense contre les pathogènes respiratoires (la cathélicine a des propriétés antivirales notamment contre l’adénovirus, l’herpès virus, les retrovirus et a également des propriétés antibactériennes et antifongiques)
- inhibe la production des cytokines pro-inflammatoires telles que le TNF alpha, INFbeta, IL8, IL6 ; (cytokine impliquées dans l’orage cytokine engendré par le sars-cov-2 chez certains patients)
- augmente la production des cytokines anti-inflammatoires
- diminue la réplication des virus de la grippe, de la dengue, et du rotavirus
- module un grand nombre des mêmes voies de signalisation inflammatoires et oxydatives déclenchées pendant le Covid-19 [12].
- soutient et améliore la réponse du système immunitaire aux infections.
- supprime l’activité du système rénine-angiotensine qui joue un rôle déterminant dans la physiopathologie de la réponse inflammatoire liée au Covid-19.
- module l’expression de l’ACE2, utilisé comme récepteur par le SARSCoV-2 pour infecter les cellules de l’hôte. La régulation négative de l’ACE2 par le SARS-CoV-2 est impliquée dans la réaction inflammatoire en cascade ou « orage cytokinique » à l’origine des complications respiratoires avec un risque élevé de décès.
- participe à la régulation de l’immunité cellulaire innée et adaptative [13].
L’hypovitaminose D est un facteur de risque indépendant de forme grave de Covid-19.
Corrélation entre le taux de Vitamine D et la prévalence de l’infection et de la mortalité par la Covid-19 et autres infections respiratoires.
Une méta-analyse de 40 essais contrôlés randomisés montre que la supplémentation en vitamine D est sûre et réduit le risque d’infections respiratoires aiguës [14].
Martineau et al., dans leur méta-analyse regroupant 10 933 participants inclus dans 25 essais cliniques randomisés, ont montré un effet protecteur global de la supplémentation en vitamine D sur les infections du tractus respiratoire. L’effet protecteur mesuré était encore plus important chez ceux recevant la vitamine D quotidiennement ou hebdomadairement (dose entre 20 et 50 μg, c’est à dire entre 800 et 2000 UI) [15].
Dans un essai clinique randomisé en double aveugle, Bergman et al. ont montré sur 14 patients à risque de faire des infections respiratoires, qu’une supplémentation en vitamine D3 à la dose de 4000 UI/ jour pendant 1 an diminuait le risque d’infection (p=0.05) [16].
Urashima et al., ont investigué l’effet de la supplémentation en vitamine D sur l’incidence de la grippe saisonnière chez des enfants d’âge scolaire. L’incidence de la grippe dans le groupe traité à la vitamine D (10.8%) était inférieur au groupe témoin (18.6%) de manière significative (p=0.04). De plus la vitamine D a également diminué significativement le nombre de crises d’asthme chez les enfants asthmatiques (p=0.006) [17].
Yadav et al. ont montré une corrélation entre le taux moyen de vitamine D des populations d’Asie Pacifique et le nombre de cas de Covid / millions d’habitants (p=0.016) ainsi qu’avec le nombre de décès par Covid / million d’habitants (p=0.093) [18].
De façon similaire, Bakaloudi et al. ont montré que la prévalence de la carence en vitamine D allait de 6.9 à 75.1% selon les pays européens dont 15 au moins avait 50% de leur population carencée. La carence en vitamine D était corrélée avec l’infection à Covid-19 et à la mortalité de manière significative [19].
Walrand et al. ont tenté de déterminer les facteurs ayant déclenché une soudaine remontée des cas en Europe à l’automne 2020. S’il n’y avait pas de corrélation avec la température ou l’humidité, il y avait en revanche une forte corrélation avec la latitude. Cette étude indique que la carence en vitamine D est un facteur contributeur de la sévérité de la Covid-19 [20].
Dans une étude de cohorte rétrospective, Demir et al. ont montré qu’à mesure que le taux de vitamine D augmente, le risque d’être infecté par le SARS-CoV-2, le nombre de segments pulmonaires atteints, les taux de CRP; et de D-dimères, la durée d’hospitalisation diminuent de manière statistiquement significative [21].
Chez 14 000 professionnels de santé qui ont été testés pour le COVID-19 du 1er février au 30 avril 2020 en Israël, le taux plasmatique moyen de vitamine D était significativement plus bas chez ceux qui ont été testés positifs que négatifs pour le COVID-19.
L’analyse univarié a d’autre part montré une association entre un taux plasmatique bas en vitamine D3 et la probabilité accrue d’une infection à Covid-19 (p< 0.001) ainsi que la probabilité accrue d’être hospitalisé bien que cette dernière tendance ne soit pas significative (p=0.061). Cette vaste étude israélienne établi un lien étroit entre la carence en vitamine D et la gravité de la maladie covid-19 [22].
Une étude de cohorte de 9548 adultes âgés de 50 à 75 ans suivis pendant 15 ans en Allemagne a montré que les individus présentant une insuffisance ou une carence en vitamine D avaient une mortalité due aux maladies respiratoires fortement accrue par rapport à ceux dont le statut en vitamine D était suffisant [23].
Une analyse révèle le mécanisme qui sous-tend la vitamine D dans la suppression de la tempête de cytokines et l’induction d’une réponse antivirale dans l’infection par le SARS-CoV-2 [24].
Enfin, de nombreuses études de revue mettent en avant les preuves du bénéfice et la recommandation de supplémentation en cas d’infection à SARS-CoV-2 [12,25–27]
⇒ Pour un aperçu de toutes les études sur la vitamine D dans le cas de la covid-19
Essais ayant testé la vitamine D comme traitement dans la Covid-19 :
Un essai contrôlé randomisé iranien sur des patients en soins intensifs sous ventilation mécanique a montré que l’’administration d’une forte dose de vitamine D (300 000 UI en intramusculaire) pourrait réduire le temps de séjour en soins intensifs (8.3±8.4 vs. 25.4±6.6 jours de séjour; p= 0.017), le temps de ventilation mécanique (15.69±9.25 vs 22.64±9.06 ;p= 0.047) ainsi que la mortalité (31.25% vs 85.71%; p=0.003 [28].
Dans l’essai Indien mené par Rastogi et al., les participants étaient randomisés pour recevoir soit 60 000 UI de cholecalciferol pendant 7 jours soit un placebo. Les patients nécessitant de la ventilation invasive ou avec des facteurs de risque ont été exclus de l’étude. La proportion de patients négativant la PCR SARS-CoV-2 avant le 21e jour (62.5% vs. 20.8%; p<0.018) et ainsi que le taux de fibrinogène (p=0.007) étaient significativement différent entre les deux groupes [29].
Dans un essai contrôlé randomisé espagnol, la vitamine D à forte dose (100 000 UI) a réduit de 96% le risque de nécessiter des soins intensifs [30].
Un autre essai randomisé mené en Espagne auprès de 930 patients hospitalisés a révélé une réduction de 80% du recours aux soins intensifs et de 60% de la mortalité chez les patients recevant de la vitamine D à forte dose [31].
Une étude menée dans une maison de retraite française a révélé une diminution de 89% de la mortalité chez les résidents qui avaient reçu une forte dose de vitamine D peu de temps avant ou pendant la maladie de Covid-19 [32].
Une étude britannique rétrospective portant sur environ 1 000 patients hospitalisés atteints de la Covid-19 a révélé une réduction de 80% de la mortalité grâce à une forte dose de vitamine D [33].
Une étude menée dans une maison de retraite italienne a révélé une mortalité inférieure de 70% avec la supplémentation en vitamine D chez les 98 résidents de maisons de retraite PCR+ [34].
Une étude rétrospective sur 537 patients en Espagne, 79 traités avec du calcifédiol, a mis en évidence une mortalité significativement plus faible avec le traitement [35].
Une étude rétrospective 16 401 patients hospitalisés en Espagne a montré une réduction significative de la mortalité associée à la prescription de vitamine D, en particulier de calcifédiol, dans les 15-30 jours précédant l’hospitalisation [36].
Schéma posologique selon la revue du praticien :
En dehors de toute infection par le SARS-CoV-2 :
· supplémenter en vitamine D toute l’année les personnes à risque de déficit en vitamine D : les personnes obèses, les personnes âgées de 75 ans ou plus, fragiles ou atteintes de maladie chronique,
· supplémenter la population générale en période hivernale.
La posologie préconisée est une prise de 50 000 UI de vitamine D3 par mois, en doublant la dose chez les sujets obèses ; l’objectif est d’obtenir une concentration en 25-0H vitamine D sérique comprise entre 20 et 60 ng/mL.
En cas d’infection par le SARS-CoV-2 :
· supplémenter à forte dose, dès le diagnostic de Covid-19 posé, sans attendre le résultat du dosage sérique de 25-0H vitamine D ;
· la recommandation est de prescrire chez l’adulte « en traitement adjuvant aux protocoles de traitements standards disponibles, une dose de charge de vitamine D dès le diagnostic de Covid-19, par exemple 100 000 UI de vitamine D3 per os (200 000 UI chez les patients obèses et/ou ayant d’autres facteurs de risque de gravité de Covid-19) à renouveler après une semaine ».
Pour un traitement précoce, la vitamine D doit être utilisée sous sa forme à action rapide, le calcifédiol.
Dans son communiqué du 22 mai 2020, l’Académie de médecine Française rappelle que :
« – que l’administration de vitamine D par voie orale est une mesure simple, peu coûteuse et remboursée par l’Assurance Maladie ;
– confirme sa recommandation d’assurer une supplémentation vitaminique D dans la population française dans un rapport en 2012 ;
– recommande de doser rapidement le taux de vitamine D sérique (c’est-à-dire la 25 OHD) chez les personnes âgées de plus de 60 ans atteintes de Covid-19, et d’administrer, en cas de carence, une dose de charge de 50.000 à 100.000 UI qui pourrait contribuer à limiter les complications respiratoires ;
– recommande d’apporter une supplémentation en vitamine D de 800 à 1000 UI/jour chez les personnes âgées de moins de 60 ans dès la confirmation du diagnostic de Covid-19.”
De même, le gouvernement britannique recommande une supplémentation en vitamine D pour les adultes, les enfants (>4 ans) à la dose de 10 µg (400 unités) de vitamine D par jour pendant l’année en cas de non-exposition à la lumière naturelle en raison des restrictions liées à la pandémie à Covid-19.
Profil de sécurité de la vitamine D
L’US Institut of Medecine relève qu’aucune étude n’a jamais observé d’effets indésirables à la supplémentation en vitamine D3 jusqu’à la dose de 10.000 UI/j.
Il recommande toutefois de ne pas dépasser la dose de 4.000 UI/j.
Le risque principal de l’administration de vitamine D est le surdosage qui est rare car difficile à atteindre.
Le comité scientifique britannique sur la nutrition (The Scientific Advisory Committee on Nutrition), l’autorité européenne de sécurité des aliments recommande de rester en dessous de la dose de 4000 UI/j soit 100 μg .
Zinc
Le zinc est un oligo-élément essentiel à la vie qui est le plus retrouvé dans le corps humain après le fer. Il serait nécessaire à plus de 10% des protéines humaines et joue de très nombreux rôles physiologiques particulièrement dans le système immunitaire.
Le zinc inhibe l’activité de l’ARN polymérase des coronavirus et bloque ainsi la réplication du virus, comme l’a découvert pour la première fois Ralph Baric, virologue spécialiste du SARS de renommée mondiale, en 2010. [1].
Les essais cliniques utilisant le zinc dans le cadre du rhume ont démontré une réduction de la durée et/ou de la gravité des symptômes [2].
De plus, la supplémentation en zinc réduit la morbidité de l’infection des voies respiratoires inférieures chez les patients pédiatriques dans les pays en développement [3] et son utilisation est reconnue dans le traitement des syndrome grippaux [4].
Enfin, l’OMS recommande la supplémentation en zinc pour améliorer les résultats du traitement chez les enfants diagnostiqués avec des infections respiratoires (WHO, Technical Report).
Des médecins américains ont rapporté une diminution de 84% des hospitalisations, une diminution de 45% de la mortalité chez les patients déjà hospitalisés et une amélioration de l’état des patients dans les 8 à 12 heures suivant un traitement précoce par le zinc en plus de l’hydroxychloroquine (HCQ) [5].
Une étude espagnole a révélé qu’un faible taux de zinc plasmatique (< 50 μg/dl) augmentait de 130% le risque de décès à l’hôpital des patients atteints de Covid-19 [6].
Une étude américaine a rapporté une résolution rapide (en quelques heures) des symptômes de la Covid-19, tels que l’essoufflement, grâce à un traitement précoce en ambulatoire avec de fortes doses de zinc [7].
Une étude allemande a montré que le traitement des patients ambulatoires atteints de Covid-19, le plus tôt possible après l’apparition des symptômes, en utilisant la trithérapie, y compris l’association de zinc et d’hydroxychloroquine à faible dose, était associé à un nombre significativement inférieur d’hospitalisations [8].
Dans une série française de 275 patients, la zincémie a pu être corrélée avec l’évolution clinique de la Covid-19. Dans cette série, seulement 25 patients avaient une carence en zinc véritable (Zincémie < 700μg/ml). Toutefois, la médiane de la zincémie des patients du groupe évoluant favorablement à la Covid-19 (970 μg/L) était statistiquement supérieure à celle du groupe à l’évolution défavorable (840 μg/L) (p< 0.001). La proportion de patient avec une carence en zinc était plus élevée dans le groupe à évolution défavorable (21%) versus le groupe à évolution favorable (4.5%) (p<0.001). La carence en zinc était associée à l’obésité et aux âges avancés [9].
Dans une étude prospective Indienne, la zincémie de 47 patients atteints de la Covid-19 a été comparée à celle de 45 témoins. La zincémie des patients atteints de Covid-19 était inférieure (médiane 74.5 μg/gl) à celle des témoins (105.8 μg/dl) de manière significative (p<0.001). 57.4% des patients atteint de Covid-19 présentaient une carence en zinc. Les patients carencés avaient une probabilité plus élevée de complications (p=0.009), plus de syndrome de détresse respiratoire aiguë (p=0.06), une corticothérapie (p=0.02), un temps d’hospitalisation prolongé (p=005) et une mortalité accrue (18.5% vs 0%, p = 0.06) [10].
Ainsi, cette thérapie non toxique facilement disponible devrait être déployée dès les premiers signes de Covid-19 [11].
Le zinc peut être administré pendant 5 jours et prolongé si nécessaire si les symptômes persistent
Aspirine
Des études ont confirmé le fort effet antiplaquettaire et anticoagulant de
l’aspirine chez les patients atteints du Covid-19 (réduction de l’hyperréactivité plaquettaire) [104], ce qui peut contribuer à prévenir les complications majeures du Covid-19 comme la thrombose, l’embolie pulmonaire et les accidents vasculaires cérébraux chez les patients à haut risque.
Comme effet supplémentaire, l’aspirine à dose intermédiaire peut également réduire ou supprimer la toux sèche caractéristique du Covid-19.
La toux sèche du Covid-19 semble être une toux induite par les Inhibiteurs de l’Enzyme de Conversion (IEC), médiée par les prostaglandines, et l’aspirine est bien connue pour inhiber les prostaglandines de type 2 et supprimer la toux des IEC [105].
Une autre étude américaine a révélé une réduction de la mortalité à 30 jours chez les patients Covid-19 de 10,5% (groupe témoin) à 4,3% (avec l’aspirine) chez les vétérans prenant de l’aspirine [106].
Une étude rétrospective américaine portant sur 400 patients a révélé une réduction de 43% des traitements aux soins intensifs et une réduction de 47% de la mortalité dans le groupe de patients traités précocement par l’aspirine [107].
Aspirine et COVID-19
Pr. Laurence Camoin, IHU Méditerranée Infection.
(10 février 2021)
Les corticostéroïdes (prednisone, budésonide) réduisent l’inflammation systémique liée à la Covid-19.
De plus, les corticostéroïdes inhalés empêchent la réplication du virus [108].
Le protocole de traitement ambulatoire précoce élaboré par McCullough et al. recommande l’utilisation de la prednisone si (et seulement si) des symptômes respiratoires liés à la Covid-19 se développent [111].
Réduit significativement les visites aux urgences et les hospitalisations et permet un temps de récupération plus court [109].
Le Budésonide inhalé aidait les personnes présentant un risque élevé de Covid-19 grave à se rétablir plus rapidement [110].
L’essai britannique PRINCIPLE a révélé que le budésonide accélérait la guérison de 3 jours et réduisait les hospitalisations et les décès de 10,3% à 8,5% [110].
En savoir plus …
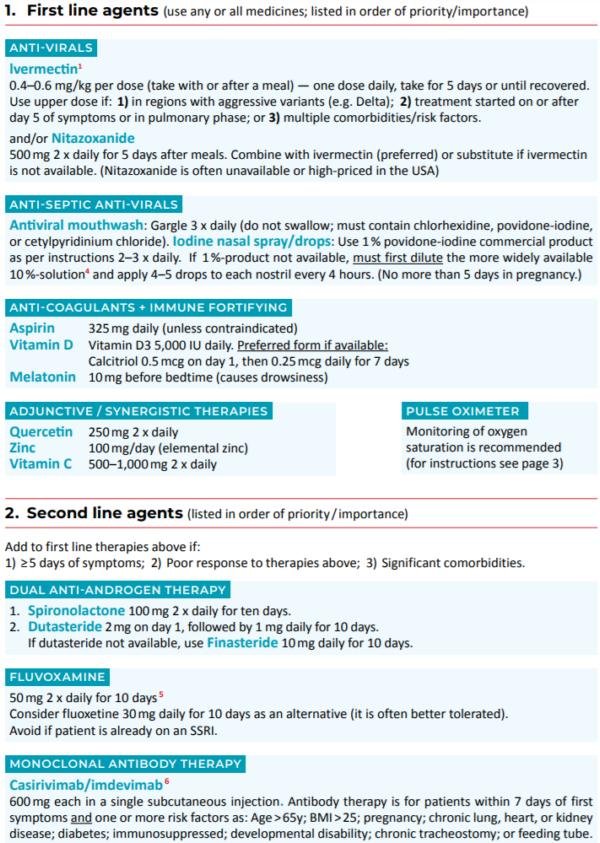
[extrait du document PRISE EN CHARGE AMBULATOIRE DU COVID-19
rédigé par : des Médecins, des Pharmaciens, des Docteurs es-sciences du collectif Réinfocovid du 26/06/2021
disponible sur le lien (version pdf)] (les références sont regroupées sur le document)
Front Line COVID-19 Critical Care Alliance
La FFCCC est une organisation à but non lucratif crée par des spécialistes en soins intensifs de renom en mars 2020 qui se consacre à l’élaboration de protocoles de traitement hautement efficaces pour prévenir la transmission de COVID-19 et améliorer les résultats pour les patients atteints de la maladie.
Missions et objectifs
Examiner toute la littérature sur COVID-19 pour développer des protocoles de traitement efficaces qui évoluent en incorporant des connaissances nouvelles , présenter les approches de traitement sûres et efficaces à toutes les phases COVID-19, au stade précoce (I-MASK+) et pour les patients hospitalisés (MATH+)
…
Médecins (lien)
Drs Paul E. Marik, Pierre Kory, G. Umberto Meduri, Joseph Varon, Jose Iglesias + membres fondateurs et conseillers cliniques
Lien vers
les page sur les protocoles COVID-19
Protocole de prophylaxie et de traitement ambulatoire précoce (I-MASK+) version Fr (pdf téléchargeable)
En prévention
Ivermectine, Vit. D3, Vit. C, Quercétine, Zinc et Mélatonine
Protocole ambulatoire précoce
Ivermectine, Fluvoxamine, assainissement nasopharyngé, Vit. D3, Vit. C, Quercétine, Zinc, Mélatonine, Aspirine
(Oxymètre de pouls)
Protocole de traitement hospitalier pour la COVID-19 (MATH+) version Fr
MÉTHYLPREDNISOLONE,
ACIDE ASCORBIQUE,
THIAMINE,
HÉPARINE,
+ IVERMECTINE, Fluvoxamine, Cyproheptadine, Vit. D, Atorvastatine, Mélatonine, Zinc, Famotidine
Rationnel clinique et scientifique du protocole MATH+ sur le site internet du journal of intensive care medecine
Ce protocole est uniquement à des fins éducatives concernant les traitements potentiellement bénéfiques pour le COVID‑19. Ne jamais négliger les conseils médicaux professionnels en raison de ce que vous avez lu sur notre site Web et dans nos communiqués. Il ne vise pas à remplacer un avis médical professionnel, un diagnostic, ou un traitement à l’égard de tout patient. Le traitement d’un patient individuel doit reposer sur le jugement de votre médecin ou d’un autre professionnel de la santé qualifié. Demander toujours leur avis pour toute question que vous pourriez avoir concernant votre santé ou votre maladie.
Avis de non responsabilité du site Front Line COVID-19 Critical Care Alliance
Le site COVEXIT.COM comporte des actualités très pertinentes sur la COVID-19 et ses traitements
le plus souvent sous forme de courts articles, podcasts ou webinar …
Et présente de nombreuses options thérapeutiques : du Protocole Raoult, Zelenko, i-MASK, Borody, à l’algorithme McCullough
Que d’espoir et de possibilités
malheureusement de nombreux patients contactent le médecin plusieurs jours après le début des symptômes ce qui réduit l’efficacité des protocoles (qui sont plus efficaces au stade viral)
mais il ne faut pas négliger la période inflammatoire (à partir du 8e jours voir ci-dessous)
Et ça change de la fameuse phrase :
« il n’y a à l’heure actuelle aucun traitement validé contre la COVID-19 »
Est-ce que cela veut dire que la médecine actuelle n’a rien à te proposer !?
Article sur le traitement du 8e jours du Dr CHETTY, Médecin et chirurgien ayant une formation avancée en génétique, biologie, biochimie et microbiologie
WEBINARS présentant divers protocoles
Protocole Zelenko
Algorithme McCullough
Traitement ambulatoire précoce en pratique :
Dr Shankara Chetty, titulaire d’un diplôme en médecine et de chirurgie et a également une formation avancée en génétique, biologie avancée, biochimie et microbiologie.
– Dr Ira Bernstein, qui est médecin de famille au Canada et chargé de cours au Département de médecine familiale et communautaire de l’Université de Toronto.
– Le Dr Peter McCullough,
cardiologue clinicien et professeur de médecine au Texas A & M University College of Medicine
Webinar sur le traitement précoce du delta
Posté sur par covexit
WEBINAR concernant le traitement du variant Delta (lien vers la page du site),
présenté par 4 médecins expérimentés dans le traitement des patients atteints de la COVID-19 :
Dr Ryan Cole de l’Idaho, États-Unis, Dr Shankara Chetty d’Afrique du Sud, Dr Pierre Kory, de NY, USA, et Dr Richard Urso du Texas, USA.
Pour en savoir plus ...
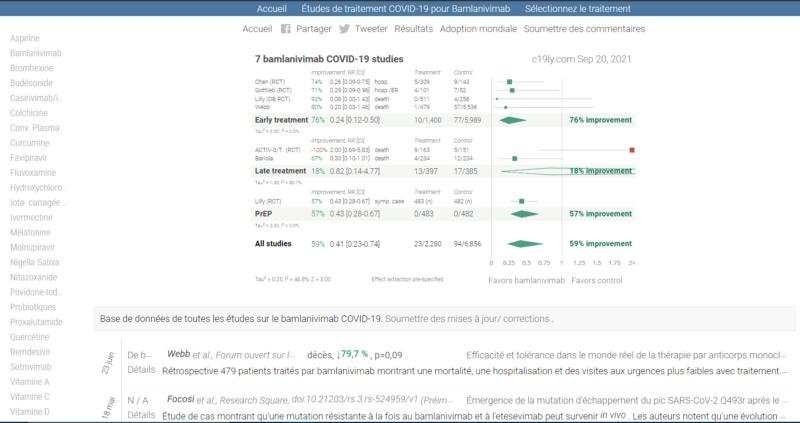
Lien vers un site qui regroupe toutes les études concernant les traitements contre la COVID-19
Les études concernant les produits/médicaments qui ont été utilisés contre la COVID-19 sont disponibles en cliquant sur le nom du produit sur la colonne de gauche ce qui permet d’accéder à la page principal qui regroupe ces études.
Le site est mis à jour en temps réel.


























Vous devez être connecté pour poster un commentaire.